5.37亿糖友的“治标”曙光:干细胞外泌体,能终结“终身用药”吗?
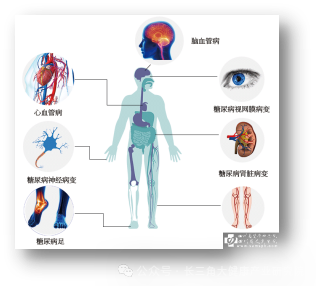
全球5.37亿成年糖尿病患者,长期陷入“治标难治本”的困境。作为全球极具挑战性的代谢疾病,即便被寄望的胰腺移植、直接干细胞移植,也因供体稀缺、术后免疫排斥、细胞存活率不足5%,难成普适方案。

而2025年1月发表于Biomimetics的一篇名为“The Potential of Mesenchymal Stem Cell-Derived Exosomes to Treat Diabetes Mellitus”的高质量综述为困境带来新方向:间充质干细胞(MSC)衍生的外泌体,这颗30-150nm的“纳米囊泡”,或能打破“只控糖不修复”的怪圈,让终结终身用药成为可能。
一、传统疗法的死穴:为何“终身用药”难突破?
糖尿病治疗长期“治标不治本”,核心是没解决病理根源:
胰岛素注射:仅补充激素,却无法阻止β细胞持续坏死,Ⅰ型糖尿病(T1DM)患者每年用量平均增加10%-15%,陷入“加量循环”。
口服降糖药:磺脲类易引发低血糖,二甲双胍伤肠胃,3-5年后多因胰岛素抵抗失效,患者只能加药或换胰岛素。
胰岛移植:每年供体不足千份,术后需终身服免疫抑制剂,感染风险增。
传统MSC治疗:细胞在高糖、炎症环境中存活率不足5%,还可能引发栓塞,临床推广受限。
而MSC外泌体恰好规避这些缺陷:它继承MSC“免疫调节+组织修复”能力,且低免疫原性、易储存、能靶向递送,是理想的“无细胞疗法”载体。
二、外泌体的“治糖逻辑”
糖尿病两大分型机制不同,外泌体通过“精准靶向”实现针对性治疗,这是其区别于传统疗法的关键。
Ⅰ型糖尿病(T1DM):T1DM因免疫系统“误杀”β细胞致胰岛素缺失,外泌体双管齐下:
1.β细胞的免疫保护
脂肪MSC外泌体(AD-MSC-ex)在T1DM大鼠模型中,可降促炎因子(IFN-γ、IL-17),升抗炎因子(IL-4、IL-10)。其机制是诱导单核细胞分化为M2型巨噬细胞,促进调节性T细胞(Treg)生成——仅拦截攻击β细胞的autoreactiveT细胞,不影响正常免疫,规避感染风险。骨髓MSC外泌体还能将树突状细胞改造为“调节型”,进一步压制自身免疫反应。
2.β细胞再生:补“新鲜兵力”
脐带MSC外泌体治疗后,T1DM小鼠胰岛体积扩大2倍,胰岛素阳性细胞率提升,且β细胞发育基因表达上调——Pdx1是β细胞成熟“主开关”,Smad2/3促增殖,确保新生细胞能正常分泌胰岛素。月经血MSC外泌体更能诱导新胰岛形成,使小鼠血糖稳定时间变长。
Ⅱ型糖尿病(T2DM): T2DM占患者90%,核心是“胰岛素抵抗+β细胞过劳坏死”,外泌体三重破局:
1.逆转抵抗:让细胞“认胰岛素”
脐带MSC外泌体能激活胰岛素信号通路,使骨骼肌细胞中磷酸化IRS-1、AKT提升,促进葡萄糖转运蛋白4(GLUT4)向细胞膜转移,葡萄糖摄取效率提高。在脂肪组织中,还能增“胰岛素敏感因子”脂联素、减“抵抗因子”瘦素,改善全身敏感性。
2.减轻炎症:为β细胞“减负”
脂肪MSC外泌体(ASC-ex)诱导M1型巨噬细胞转成抗炎M2型,降低炎症因子(TNF-α、IL-6),缓解手脚发麻、皮肤瘙痒等并发症预警,降低肾病、神经病变风险。
3.保护β细胞:防“过劳死”
长期高糖致β细胞缺氧、凋亡,外泌体中miR-21可抑制内质网应激蛋白(eIF2α、CHOP),阻断凋亡通路,缺氧下β细胞凋亡率降低,T2DM小鼠β细胞数量比对照组增加。

对5.37亿糖友而言,MSC外泌体不是“立刻治愈”的奇迹,却是“减药直至自主调节”的希望。它从病理根源出发,为T1DM护β细胞,为T2DM逆转抵抗,这种“修复式治疗”是糖尿病从“控制”走向“治愈”的关键。随着技术成熟, “终身用药”的标签将被撕掉,糖友能回归正常生活——这一切,始于科研者对病理的深耕,也源于对患者“摆脱依赖”渴望的回应。
参考文献
Kim JE, Lee JW, Cha GD, Yoon JK. The Potential of Mesenchymal Stem Cell-Derived Exosomes to Treat Diabetes Mellitus. Biomimetics (Basel). 2025 Jan 14;10(1):49. doi:10.3390/biomimetics10010049. PMID: 39851765; PMCID: PMC11760843.